Der Schalenbau der Ostracoden
 This text, unless otherwise expressly stated, is licensed under a Creative Commons Attribution-Share Alike 3.0 Germany License.
This text, unless otherwise expressly stated, is licensed under a Creative Commons Attribution-Share Alike 3.0 Germany License.Inhalt:
- 1. Morphologie
- 2. Schalenbau
- 2.1 Epicuticula
- 2.2 Exocuticula
- 2.3. Endocuticula
- 3. Auswirkungen von chemischen Prozessen
- 4. Terminologie der Ostracodenklappe
- 5. offen
- 6. Literatur
Schalenaufbau und Morphologie der Ostracoden
1. Morphologie
Ostracoden gehören zur Gruppe der Crustaceen und ihr Körper ist im Gegensatz zu den übrigen Arthropoden nur schwach segmentiert (Abb.1). Cephalon und Thorax sind morphologisch nur undeutlich getrennt, das Abdomen ist nur rudimentär vorhanden und zur Furca umgebildet. Eine Besonderheit der Ostracoden ist, daß der gesamte Weichkörper zusammen mit seinen Anhängen von zwei kalkigen Klappen umschlossen wird.
Diese Klappen unterscheiden sich häufig in Form und Skulptur voneinander und werden dorsal durch Schloß und Ligament zusammengehalten. Hinzu kommt ein Muskelapparat, der auf der Klappeninnenseite befestigt ist und dort ein charakteristisches Narbenfeld hinterläßt. Bei einigen Gattungen spielt dieses Muskelnarbenfeld als taxonomisches Merkmal bei der Artbestimmung eine wichtige Rolle. (LEHMANN & HILLMER, 1983; HINZ-SCHALLREUTHER & SCHALLREUTHER, 1999)
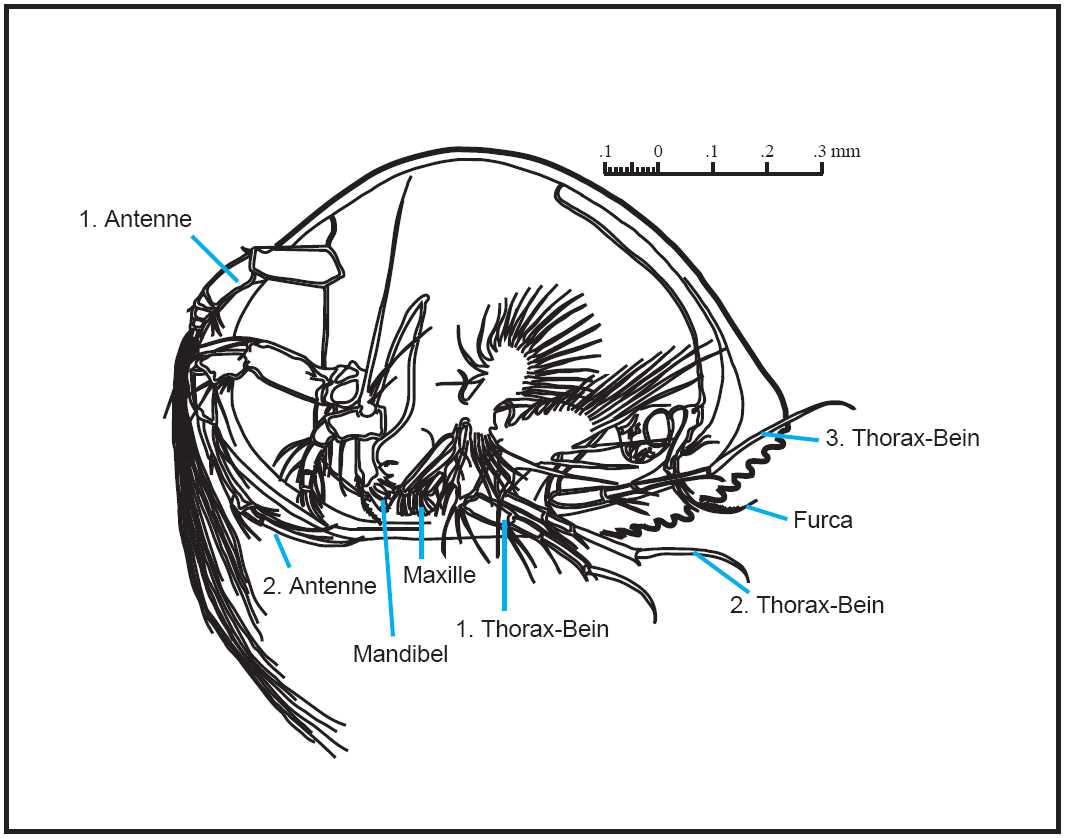
Abb.1 Bauplan einer rezenten Ostracode (Gattung Bairdia) nachgezeichnet nach Benson et al. (1961)
2. Schalenaufbau
Das Ostracodengehäuse besteht aus zwei an den Schalenrändern zusammenhängenden Schalenblättern. Sie werden als Außen‑ und Innenlamelle bezeichnet (Abb.2). Nur die Außenlamelle ist in ihrer ganzen Breite kalkig ausgebildet, weshalb sich folgende Ausführungen auch nur auf diese beziehen.
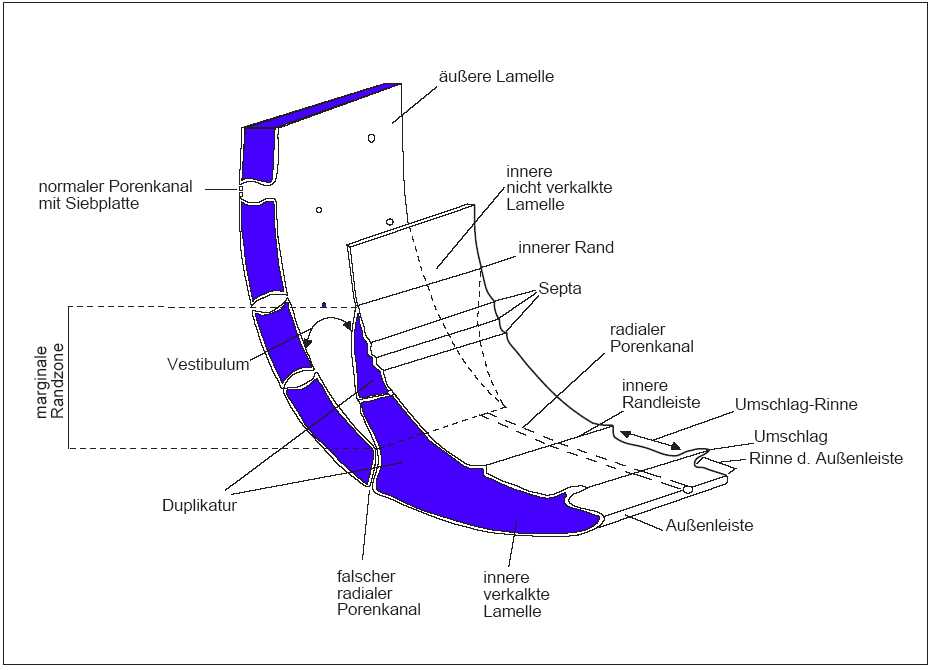
Abb. 2: Strukturen und Terminologie der Randzone, schematisch nach Oertli (1985)
Da eine zuverlässige Artbestimmung vom Aufbau der Schale und damit auch von der Schalenerhaltung abhängig ist, soll erstere kurz dargestellt werden. Im Gegensatz zu den Muscheln, deren Gehäuse akkretionär gebildet werden, erfolgt die Schalenbildung bei Ostracoden durch Synthese. Damit werden die Tiere vom Chemismus des Meerwassers unabhängiger und können auch in großer Tiefe eine dicke, stark skulptierte Schale entwickeln (vgl. BENSON, 1988). Insgesamt lassen sich 3 Schichten unterscheiden (vgl. Abb. 3):
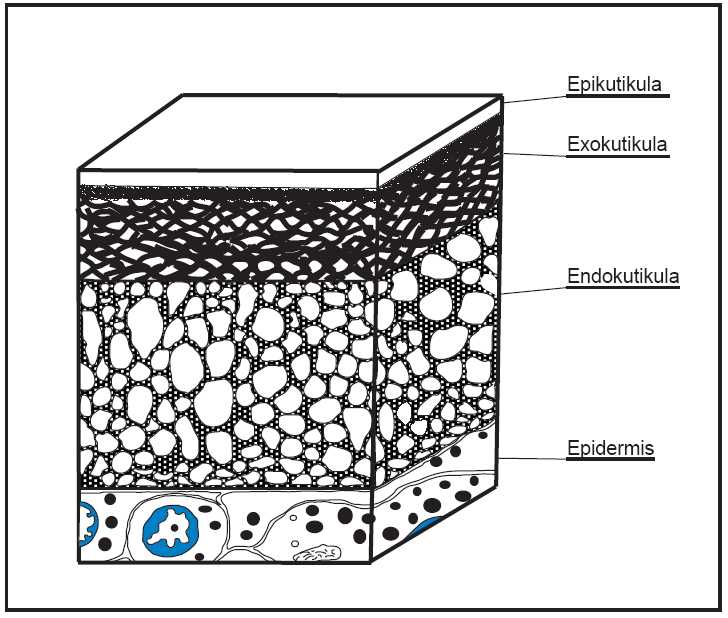
Abb. 3: Aufbau der Ostracodenschale, schematisch nach Bate & East (1972)
2.1. Epicuticula:
Früher wurde sie als äußere, wachsartige Chitinschicht bezeichnet (MÜLLER 1894). Sie stellt die äußerste Schicht dar und besteht aus rein organischem Material. Dabei handelt es sich jedoch nicht um Chitin, sondern um eine Verbindung aus Lipiden, Polyphenolen und Proteinen (LANGER, 1971; 1973). Die Epicuticula soll die Schale beim lebenden Tier vor chemischen Lösungsprozessen schützen. Bei fossilen Ostracoden ist sie bisher nicht überliefert.
2.2. Exocuticula:
Sie folgt auf die Epicuticula und besteht aus einer komplizierten Anordnung von Calcitkristallen und aus einem Chitin-Protein-Komplex (kurz: “Chitin”) bestehenden Stützpfeilern oder Fabrillen, die ein stabiles und elastisches Gerüst bilden. Die Calcitkristalle sind oberflächenparallel angeordnet, dachziegelartig übereinander gestapelt, und im Gerüst eingebettet. So ergibt sich eine sehr dichte und kompakte Schicht. Die Oberfläche der Exokutikula bildet auch die Skulptur und die tiefer liegenden Schichten zeichnen sie nach, wobei die Skulptur jedoch zur Klappeninnenseite hin immer flacher wird.
2.3. Endocuticula:
Auch hier liegen Calcitkristalle in einem “Chitin”-Gerüst vor, die Anordnungen ist jedoch sehr viel lockerer als bei der Exocuticula, obwohl diese Schicht dicker ist. Auch ist der organische Anteil geringer. Im Gegensatz zu früheren Vermutungen, ist bei Ostracoden keine innere “Chitin”-Schicht vorhanden (BATE & EAST, 1972; LANGER, 1973; HERRIG, 1987). SYLVESTER-BRADLEY & BENSON (1971) konnten bei einer rezenten Ostracodenschale eine sehr dünne (max. 1 ⅿ dick) laminare Schicht beobachten, deren Zusammensetzung jedoch weitgehend unbekannt ist.
3. Auswirkungen von chemischen Prozessen
Vor allem während der Diagenese der Sedimente, in denen die Mikrofossilschalen nach deren Absterben eingebettet wurden, ändert sich die Zusammensetzung der Schale. Die Epicuticula und die chitinöse Stützlamellen werden in der Regel rasch durch Mikroorganismen zerstört, so daß Porenlösungen mit den übrigen Schalenteilen reagieren können. Ein Teil der Calcitkristalle aus Exo‑ und Endocuticula wird gelöst, andere werden durch syntaxiale Zementation vergrößert. Die Orientierung der Kristalle bleibt dabei zwar erhalten, die neu gebildeten Prismen sind nun aber quer zur Schalenoberfläche orientiert. Dabei können die über die Oberfläche hinaus wachsenden Kristalle von rhomboedrischer oder tafeliger Gestalt sein (Sparitisierung). Die Porosität der Schale nimmt im Zuge der Zementation ab.
Diagenetische Vorgänge können jedoch zur Pyritisierung oder zur Inkrustation durch Calcit führen. Bei ersterer soll nach HERRIG (1987) bei der Verwitterung des Eisensulfids Schwefelsäure freigesetzt werden, welche die Calcitschalen angreift. Chemische Korrosion führt sehr häufig zu einer Verflachung der Skulptur bis hin zur Glättung der Schale. Dies kann vor allem in Profilen der Langenbrückener Senke beobachtet werden. Bei dem Exemplar auf Abb. 4 ist die Exocuticula stark weggelöst.

Abb. 4: Exemplar mit stark weggelöster Exocuticula.
Problematisch bei den oben angeführten Prozessen ist, daß die ursprüngliche Gestalt der Ostracodenklappe mehr oder weniger stark verändert wird. Durch Sparitisierung wird die Skulptur verdeckt, die Vertiefungen auf der Klappenoberfläche werden vielfach aufgefüllt und die Oberfläche sekundär geglättet (vgl. Abb.5).

Abb. 5: Exemplar, bei dem die Skulptur durch Sparitisierung stark verdeckt wird.
Dadurch werden auch das Muskelfeld und die Mikroskulptur unkenntlich, Calcitrhomboeder oder –täfelchen täuschen durch ihre Lichtbrechung unter dem Binokular Skulpturelemente vor, die nicht vorhanden sind. Eine Artbestimmung wird sowohl unter dem Lichtmikroskop als auch unter dem Rasterelektonenmikroskop oftmals unmöglich.
Da die einzelnen Arten vor allem bei den merkmalsarmen, glattschaligen Gattungen, wie Ledahia, Ogmoconcha und Ogmoconchella im Umriß stark übereinstimmen, spielen Unterschiede im Muskelfeld oder Feinbau des Schlosses, sowie in ihrer Mikroskulptur eine große Rolle (GRÜNDEL, 1964; HERRIG, 1975).
Beispielsweise können die Arten Ogmoconchella adenticulata (DREXLER) und Ogmoconchella danica MICHELSEN nur an geringfügigen Abweichungen ihrer feinpapillaten Mikroskulptur und im Schloßbau unterschieden werden. Sind diese Strukturen von Sparit überdeckt oder weggelöst, ist eine Artbestimmung nicht mehr möglich.
4. Terminologie der Ostracodenklappe
In Abb. 6 werden am Beispiel einer schematisch dargestellten Klappe einer mesozoischen Ostracode die wichtigsten terminologischen Begriffe erläutert. Der Begriff Kardinalwinkel wird häufig in der Literatur durch Dorsalwinkel ersetzt, wobei der vordere und hintere Dorsalwinkel dem vorderen und hinteren Kardinalwinkel entspricht. Das Vestibulum ist ein freier Raum zwischen äußerer und innerer Lamelle. In Abb. 7 sind die wichtigsten Skulpurelemente dargestellt.
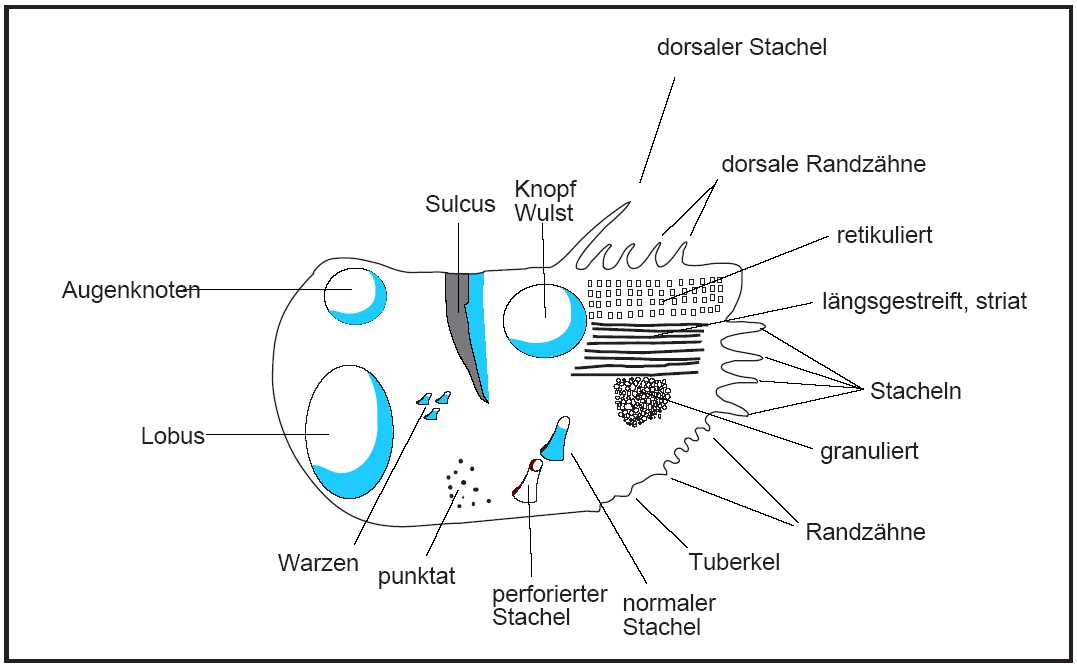
Abb. 6: Internansicht einer rechten, post-paläozoischen Ostracodenklappe, schematisch nach Oertli (1985)
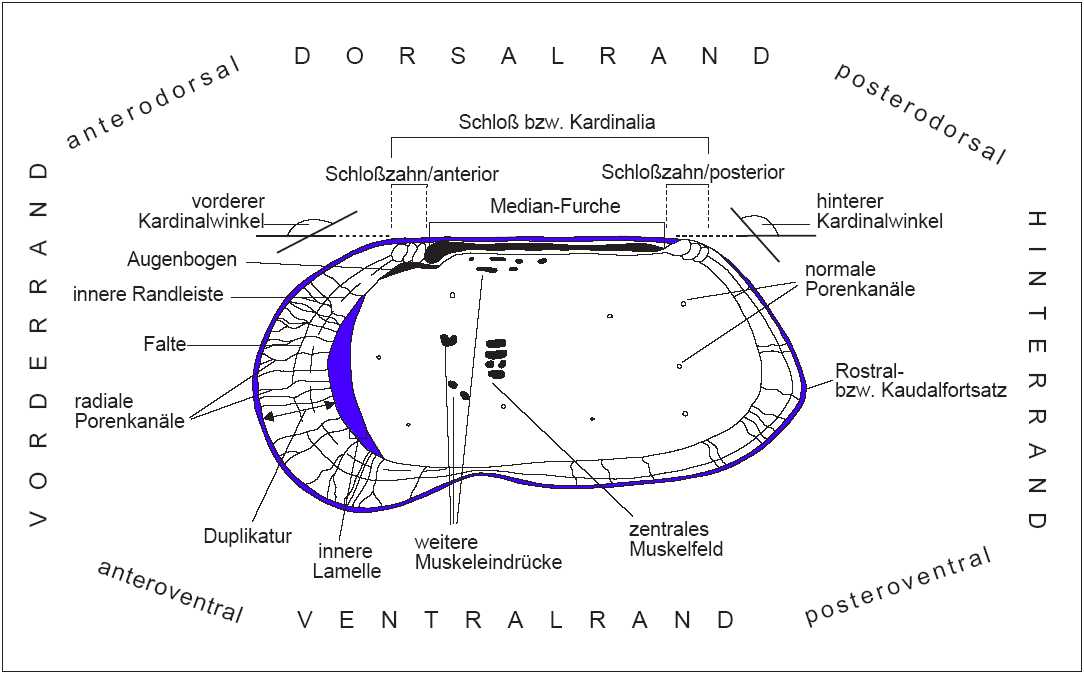
Abb. 7: Skulpturelemente einer Ostracodenklappe, umgezeichnet nach Benson et al. (1961) und Oertli (1985)
Der vorliegende Text ist ein Auszug aus:
BEHER; E: (2001): Biostratigraphie mit Ostracoden im Ober-Sinemurium von Süddeutschland und Nordschweiz.- Diss. Univ. Heidelberg, 278 S., 54 Abb., 17 Taf., 1 Tab.; Heidelberg. Manuskript
6. Literatur
BATE, R. H. & EAST, B. A. (1972): The structure of the ostracode carapace. – Lethaia, 5/2: 177–194, 11 Abb.; Oslo.
BENSON, R. H. (1988): Ostracods and Palaeoceanography. – In: DEKKER, DE P., COLIN, J.-P. & PEYPOUQUET, J.-P. (Hrsg.): Ostracoda in the Earth Science. – S. 1–26; Elsevier.
BENSON, R. H., BERDAN, J.M., BOLD, W. A. VAN DEN, HANAI, T., HESSLAND, I., HOWE, H. V., KESLING, R. V., LEVINSON, S. A., REYMENT, R. A., MOORE, R. C., SCOTT, H. W., SHAVER, R., H., SOHN, Ⅰ. G., STOVER, Ⅼ. E., SWAIN, F. M., SYLVESTER-BRADLEY, P. C., WAINWRIGHT, J. (1961): Crustacea, Ostracoda. – In: MOORE, R. Ⅽ. (Hrsg.): Treatise on Invertebrate Palaeontolgy, Part Q, Arthropoda 3. – Geol. Soc. of Amerika a. Univers. of Kansas Press, 442 S., 335 Abb. 1 Tab.; Kansas.
GRÜNDEL, J. (1964): Zur Ausbildung und taxionomischen Bedeutung der Narben der zentralen Muskelgruppe in der Unterklasse Ostracoda. – N. Jb. Geol. Paläont., Mh., 1964/10: 577–597, 11 Abb., 1 Tab.; Stuttgart.
HERRIG, E. (1975): Über Schalen-Inkrustationen bei Ostracoden (Crustacea). – Z. geol. Wiss., 3/5: 671–685, 6 Abb., 3 Taf.; Berlin.
HERRIG, E. (1987): Zur taxonomischen Bewertung schalenmorphologischer Details bei marinen postpaläozoischen Ostrakoden (Crustacea). – Z. geol. Wiss., 15/6: 739–752, 1 Abb., 5 Taf.; Berlin.
HINZ-SCHALLREUTHER, I. & SCHALLREUTHER, R. (1999): Ostrakoden. – 168 S., 255 Abb.; Stuttgart (Enke).
LANGER, W. (1971): Rasterelektronenmikroskopische Beobachtungen über den Feinbau von Ostracoden-Schalen. – Paläont. Z., 45/3–4: 181–186, 2 Abb., Taf. 22–23; Stuttgart.
LANGER, W. (1973): Zur Ultrastruktur, Mikromorphologie und Taphonomie des Ostracoden-Carapax. – Palaeontographica, A, 144/1–3: 1–55, 27 Abb., Taf. 1–15; Stuttgart.
LEHMANN, U. & HILLMER, G. (1983): Fossil invertebrates. – 350 S., 265 Abb.; Cambridge-London-New York-New Rochelle-Melbourne-Sidney (Cambridge University Press).
MÜLLER, G. W. (1894): Die Ostracoden des Golfes von Neapel und der angrenzenden Meeresabschnitte. Fauna und Flora des Golfes von Neapel. – Staz. Naples, Monogr. 21: 1–404, 13 Abb., 6 Tab., Taf. 1–40; Berlin.
OERTLI, H.-J. (1985): Indroduction. – In: OERTLI, H. J. (Hrsg.): Atlas des Ostracodes de France, Mém. Elf-Aquitane, 9: 11–31, 5 Abb.; Pau.
SYLVESTER-BRADLEY, P. C. & BENSON, R. H. (1971): Terminology for surface features in ornate Ostracodes. – Lethaia, 4/3:249–286, 48 Abb.; Oslo.